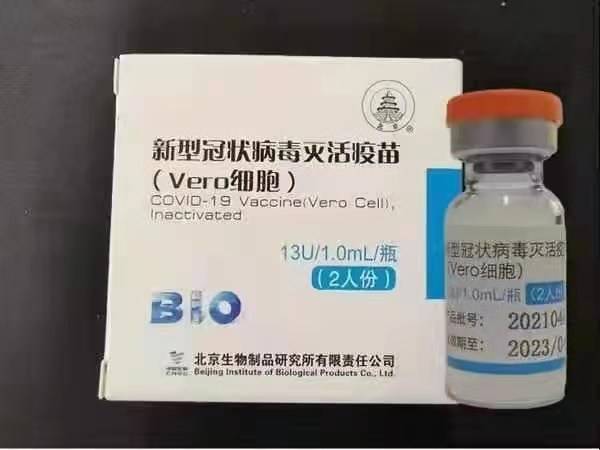
Sinopharm(베이징): BBIBP-CorV
1단계
1 시험
ChiCTR2000032459
중국
2 단계
2 시험
NCT04962906
아르헨티나
ChiCTR2000032459
중국
3단계
6 시험
NCT04984408
ChiCTR2000034780
아랍 에미리트
NCT04612972
페루
NCT04510207
바레인, 이집트, 요르단, 아랍에미리트
NCT04560881, BIBP2020003AR
아르헨티나
NCT04917523
아랍 에미리트
승인
WHO 긴급 사용 목록 59개국
앙골라, 아르헨티나, 바레인, 방글라데시, 벨로루시, 벨리즈, 볼리비아(다원 국가), 브라질, 브루나이 다루살람, 캄보디아, 카메룬, 차드, 중국, 코모로, 이집트, 적도 기니, 가봉, 감비아, 조지아, 가이아나, 헝가리 、이란(이슬람 공화국)、이라크、요르단、키르기스스탄、라오 인민 민주 공화국
레바논, 말레이시아, 몰디브, 모리타니, 오리티우스, 몽골, 몬테네그로, 모로코, 모잠비크, 나미비아, 네팔, 니제르, 북마케도니아, 파키스탄, 파라과이, 페루, 필리핀, 콩고 공화국, 에네갈, 세르비아, 세이셸, 시에라리온, 제도、소말리아、스리랑카、태국、트리니다드토바고、튀니지、아랍에미리트、베네수엘라(볼리바리아공화국)、베트남、짐바브웨
Sinopharm BBIBP-CorV COVID-19는 병원성 능력이 없는 배양 배양 바이러스 입자로 만든 불활성화 백신입니다. 이 백신 후보는 Sinopharm Holdings와 Beijing Institute of Biological Products에서 개발했습니다.
Sinopharm BBIBP-CorV 백신은 면역 체계가 SARS-CoV-2 베타 코로나바이러스에 대한 항체를 생산하도록 함으로써 작동합니다. 비활성화된 바이러스 백신은 광견병 백신 및 A형 간염 백신과 같이 수십 년 동안 사용되어 왔습니다. 이 개발 기술은 광견병 백신 등 잘 알려진 많은 백신에 성공적으로 적용되었습니다.
Sinopharm의 SARS-CoV-2 균주(WIV04 균주 및 라이브러리 번호 MN996528)는 중국 우한의 Jinyintan 병원에서 환자로부터 분리되었습니다. 이 바이러스를 Competent Vero 세포주에서 배양하고, 감염된 세포의 상등액을 β-propiolactone(1:4000 vol/vol, 2~8℃)으로 48시간 동안 불활성화시켰다. 세포 파편의 정화 및 한외여과 후, 첫 번째 불활성화와 동일한 조건에서 두 번째 β-프로피오락톤 불활성화를 수행하였다. WHO에 따르면 백신은 0.5mg의 명반에 흡착되어 방부제가 없는 0.5mL의 멸균 인산염 완충 식염수에 미리 채워진 주사기에 로드되었습니다.
2020년 12월 31일, 국가 의약품 안전청은 Sinopharm이 개발한 실험용 백신의 승인을 발표했습니다.
2021년 5월 7일 세계보건기구(WHO)는 백신 승인을 발표했습니다. WHO의 긴급 사용 목록을 통해 국가는 COVID-19 백신 수입 및 관리에 대한 자체 규제 승인을 신속하게 처리할 수 있습니다. 예방접종 전략에 관한 WHO 자문 전문가 그룹도 백신에 대한 검토를 완료했습니다. 사용 가능한 모든 증거를 바탕으로 WHO는 18세 이상 성인에게 3주에서 4주 간격으로 2회 백신 접종을 권장합니다. 증상이 있는 질병과 입원한 질병에 대한 백신의 효능은 모든 연령대를 합하여 79%로 추정됩니다.
미국 의학 협회(American Medical Association)는 2021년 5월 26일 "A Randomized Clinical Trial: Effect of 2 Inactivated SARS-CoV-2 Vaccines on Symptomatic COVID-19 Infection in Adults"(성인의 증상이 있는 COVID-19 감염에 대한 2가지 비활성화된 SARS-CoV-2 백신의 효과)를 발표하면서 "무작위 임상 시험의 사전 지정된 중간 분석에서, 성인 무작위 임상 시험의 사전 지정된 중간 분석에서 투여된 2개의 비활성화된 SARS-CoV-2 백신은 증상이 있는 COVID-19의 위험을 유의하게 감소시켰고 심각한 부작용은 드물었습니다." 성인을 대상으로 한 이 3상 무작위 시험에서 2개의 비활성화된 전체 바이러스 백신의 증상이 있는 COVID-19 사례의 효능은 각각 72.8% 및 78.1%였습니다. 2개의 백신은 명반 단독 대조군과 유사한 빈도로 드물게 중대한 이상반응을 보였고 대부분은 백신 접종과 관련이 없었다. 탐색적 분석은 2개의 백신이 1/2상 시험의 결과와 유사한 측정 가능한 중화 항체를 유도한다는 것을 발견했습니다.
WHO SAGE 워킹 그룹은 2021년 5월 10일 Sinopharm/BBIBP COVID-19 백신에 대한 리뷰를 발표했습니다. GAVI의 COVID-19 백신에는 백신이 적절하게 보관되었고 노출되지 않았는지 의료진에게 알려주는 백신 바이알 모니터가 포함되어 있습니다. 과열. 그 결과, 손상, 손상, 2021년 5월 14일 GAVI 보고했습니다. Zebra Technologies에서 제조하고 Temptime Corporation에서 제조한 스마트 라벨은 중앙에 더 밝은 색상의 사각형이 있는 원으로 구성되며, 시간이 지남에 따라 색상을 비가역적으로 발전시키는 무색 화학 물질로 만들어집니다. . 누적 열 노출을 시각적으로 나타내기 위해 어두워집니다. 바이알이 최적의 보관 범위를 넘어 열에 노출되면 사각형이 원보다 어두워지며 이는 백신을 더 이상 사용하지 않아야 함을 나타냅니다.
National Drug BBIBP-CorV COVID-19 백신 의약품 라이브러리 등록 번호: DB15807.